การคัดเลือกและจัดตั้งโคโลนีหนูแรท Mlac:WR ที่มีอุบัติการณ์ไตบวมน้าต่า ที่ศูนย์สัตว์ทดลองแห่งชาติ มหาวิทยาลัยมหิดล ประเทศไทย
คำสำคัญ:
หนูแรทสายพันธุ์ Wistar, Mlac:WR, ไตบวมน้ำ, การคัดเลือก, ศูนย์สัตว์ทดลองแห่งชาติบทคัดย่อ
การศึกษานี้มีวัตถุประสงค์เพื่อจัดตั้งโคโลนีหนูแรท Mlac:WR ที่มีอุบัติการณ์ไตบวมน้าต่าที่ศูนย์สัตว์ทดลองแห่งชาติ มหาวิทยาลัยมหิดล ประเทศไทย พ่อแม่พันธุ์หนูแรท Mlac:WR จานวน 20 คู่ในโคโลนีตั้งต้นของศูนย์สัตว์ทดลองแห่งชาติถูกสุ่มขึ้นมาเพื่อใช้ในการตรวจหาเปอร์เซ็นต์การเกิดอุบัติการณ์ไตบวมน้า พบว่ามีเปอร์เซ็นต์การเกิดไตบวมน้าอยู่ที่ 9.66% ของประชากร การคัดเลือกพ่อแม่พันธุ์เพื่อดาเนินการสืบสายพันธุ์นั้นใช้การคัดเลือกด้วยวิธีการคัดเลือกจากลักษณะของรุ่นลูก ร่วมกับหลักการสืบสายพันธุ์หลีกเลี่ยงการเกิดเลือดชิดมากที่สุด และระบบการผสมพันธุ์แบบหมุนวน คู่พ่อแม่พันธุ์ที่ให้ลูกที่มีลักษณะไตบวมน้าถูกคัดออกจากโคโลนี และถูกทดแทนด้วยลูกที่มาจากคู่พ่อแม่พันธุ์อื่นที่มีสุขภาพดีในกลุ่มเดียวกันในรุ่นถัดไป ผลจากการคัดเลือกและสืบสายพันธุ์พบว่า อุบัติการณ์ไตบวมน้า มีค่า 7.5% ในรุ่นที่ 0 ลดลงเหลือ 1.07%-1.72% ในรุ่นที่ 2-4 และลดลงเป็น 0.00% ในรุ่นที่ 5 อย่างไรก็ตาม ได้พบอุบัติการณ์ไตบวมน้า มีค่า 0.49% ในรุ่นที่ 6-7 ลดลงเป็น 0.00% ในรุ่นที่ 8 และพบว่า มีค่า 0.42%-1.02% ในรุ่นที่ 9-10 ทั้งนี้เนื่องจากลักษณะไตบวมน้าเป็นลักษณะที่เกี่ยวข้องกับพันธุกรรมและถูกควบคุมด้วยยีนหลายยีน ดังนั้นจึงไม่สามารถกาจัดออกจากโคโลนีได้อย่างสมบูรณ์
เอกสารอ้างอิง
Anderson JC. Hydronephrosis. 1st ed. London, UK: Butterworth-Heinemann; 1963.
Niesterok C, Köhler C, Alef M, Kiefer I. Causes of hydronephrosis in dogs and cats. Ultraschall in der Medizin-European Journal of Ultrasound 2016;37:PS1_02.
Karlson AG, Kernkamp HCH. Hydronephrosis in swine. Iowa State University Veterinarain 1941;4:18-20.
Harrison GD, Biller D, Wilson DG, Castleman WL. Ultrasonographic diagnosis of hydro-nephrosis in a cow. Veterinary Radiology and Ultrasound 2005;33:49-51.
Sellers AL, Rosenfeld S, Friedman NB. Spontaneous hydronephrosis in the rat. Proceedings of the Society for Experimental Biology and Medicine 1960;104:512-5.
Anver MR, Cohen BJ, Lattuada CP, Foster SJ. Age-associated lesions in barrier-reared male Sprague-Dawley rats: A comparison between Hap: (SD) and Crl:COBS[R]CD[R] (SD) stocks. Experimental Aging Research 1982;8:3-24.
Burton DS, Maronpot RR, Howard FL3rd. Frequency of hydronephrosis in Wistar rats. Laboratory Animal Science 1979;29(5): 642-4.
Friedman J, Hoyer JR, Mccormick B, Lewy JE. Congenital unilateral hydronephrosis in the rat. Kidney International 1979;15(5):567-71
National Research Council. Guide for the care and use of laboratory animals. 8th ed. Washington DC, USA: The National Academic Press; 2011.
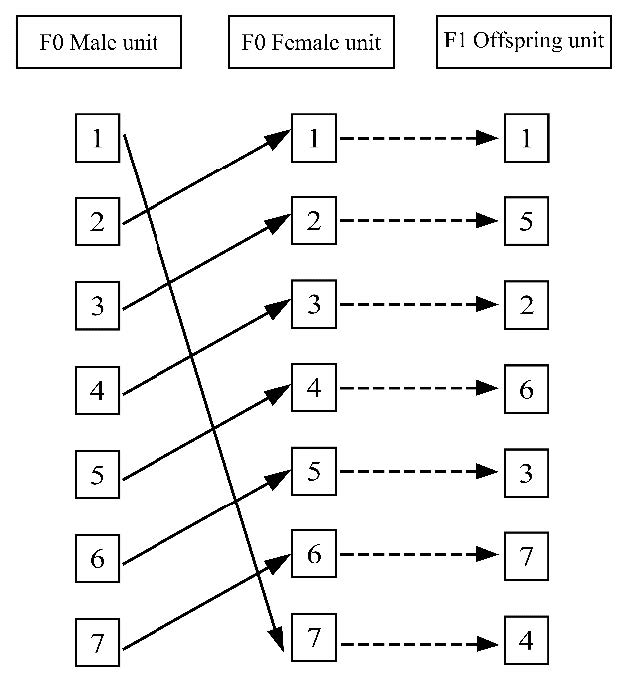
Poiley SM. A systematic method of breeder rotation for non-inbred laboratory animal colonies. Proceedings of the Animal Care Panel 1960;10:156-66.
King WW, Russell SP. Metabolic, traumatic, and miscellaneous diseases. In: Suckow MA, Weisbroth SH, Franklin CL, editors. The Laboratory Rats. 2nd ed. Amsterdam: Elsevier Academic Press; 2006. p. 531-2.
Lozzio BB, Chernoff AI, Machado ER, Lozzio CB. Hereditary renal disease in a mutant strain of rats. Science 1967;156(3783):1742-44.
Kota L, Schulz H, Falak S, Hübner N, Osborne-pellegrin M. Localization of genetic loci controlling hydronephrosis in the Brown Norway rat and its association with hematuria. Physiological Genomics 2008;34(6):215-24.
ดาวน์โหลด
เผยแพร่แล้ว
ฉบับ
ประเภทบทความ
สัญญาอนุญาต
บทความทุกบทความที่ตีพิมพ์ในวารสารการพัฒนางานประจำสู่งานวิจัย (JPR2R) ถือว่าเป็นลิขสิทธิ์ของวารสารการพัฒนางานประจำสู่งานวิจัย คณะสิ่งแวดล้อมและทรัพยากรศาสตร์ มหาวิทยาลัยมหิดล





